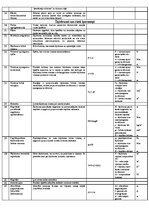
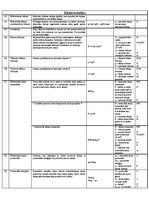
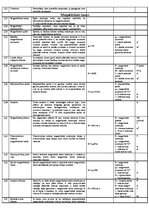
Relatīvā atommasa
Vielas atoma (vai molekulas) masas attiecība pret 1/12 oglekļa izotropa atoma masas
Difūzija
Difūzija ir kādas vielas molekulu iespiešanās citas vielas starpmolekulu telpā
Gāzes spiediens
Molekulu iedarbības spēka moduļa attiecība pret sienas virsmas laukumu ir viena un tā pati
Brauna kustība
Par Brauna kustību sauc šķidrumā vai gāzē iejauktu sīku vielas daļiņu nepārtrauktu, haotisku kustību
Molekulārkinētis-kās teorijas pamatvienādojums
Molekulu vidējais kvadrātiskais ātrums
Visu molekulu ātruma projekcijas kvadrāta vidējā vērtība
Ideālās gāzes spiediens
Ideālās gāzes spiediens ir tieši proporcionāls molekulu koncentrācijas un molekulu virzes kustības vidējās kinētiskās enerģijas reizinājumam
Termodinamiskās sistēmas parametrs
Lielumi, kas raksturo termodinamiskās sistēmas stāvokli, bet neinteresējas par sistēmas uzbūvi (makroskopiskie lielumi)
Siltuma līdzsvars
Tāds stāvoklis, kad visi termodinamiskās sistēmas stāvokļa parametri visās tās daļās laikā nemainās
Temperatūra
Fizikāls lielums, kas raksturo siltuma līdzsvara stāvokli
Lošmita skaitlis
Gāzes molekulu koncentrācija normālos apstākļos
Ideālās gāzes stā-vokļa vienādo-jums (Mendeļejeva - Klapeirona vienādojums)
Izoparametriskie procesi
Gāzes stāvoklis mainās tā, ka tās masa un viens no 3 parametriem – p, T, V – laikā nemainās:
Izotermiskais ( T = const )
Izohoriskais ( V = const )
Izobāriskais ( p = const )
Termodinamikas pamati
Iekšējā enerģija
Ķermeņa daļiņu kopējo kinētisko enerģiju un potenciālo enerģiju sauc par ķermeņa pilno iekšējo enerģiju
Ideālās gāzes iekšējā enerģija
Ideālās gāzes iekšējā enerģija ir visu tās molekulu kinētisko enerģiju summa
Reālās gāzes iekšējā enerģija
Visu molekulu kinētiskās enerģijas un potenciālās enerģijas summa, kur reālās gāzes iekšējā enerģija atkarīga no temperatūras un tilpuma.
…
Fizikas pārskats par 11. klases mācību vielu - termini + formulas