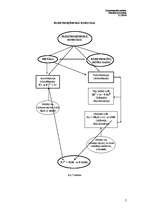
Elektroķīmiskā korozija norisinās metāliem saskaroties ar mitru gaisu vai elektrolītu
ūdens šķīdumiem. Uz metāla virsmas parasti noris divu veidu reakcijas:
anodreakcija (oksidēšanās), kuras rezultātā tiek izdalīti
elektroni,
katodreakcija (reducēšanās), kurā izdalītie elektroni tiek
pievienoti.
Pilnīgi tīri metāli praktiski nekorodē, jo ūdenī vai elektrolītu šķīdumā uz metāla un
šķīduma saskares virsmas izveidojas elektriskais dubultslānis, kas kavē metālu jonus pāriet
šķīdumā. Parasti tehniskie metāli nav pilnīgi tīri un satur citu metālu piemaisījumus, kas rada
korozijai labvēlīgus apstākļus. No dažādas aktivitātes metāliem izveidojas nepārtrauktas
darbības galvaniskais elements. Piemēram, ja kontaktā atrodas dzelzs un varš, tad abu metālu
saskares virsmai pārklājoties ar ļoti plānu ūdens plēvīti (mitrumā), veidojas korozijas
galvaniskais elements, kurā negatīvais elektrods ir dzelzs (-0.44 V), bet pozitīvais - varš
(+0.337 V). Dzelzs oksidējas (šķīst):
Fe → Fe2+ + 2e-
Atbtīvotie elektroni pāriet uz varu (4.1a*.zīm.), uz kura virsmas tie reducē ūdenī izšķīdušo
skābekli (notiek skābekļa depolarizācija):
O2 + 2H2O + 4e- → 4OH-
Šķīdumā Fe2+ joni savienojas ar OH- joniem un izveido divvērtīgās dzelzs hidroksīdu
Fe(OH)2, kas gaisā oksidējas par trīsvērtīgās dzelzs hidroksīdu Fe(OH)3:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
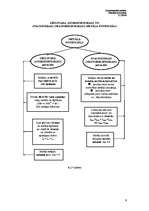
Ja dzelzs korozija noris nevis neitrālā, bet vāji skābā vidē, reducējas ūdeņraža joni (ūdeņraža
depolarizācija) nevis skābeklis (4.1b*.zīm.):
2H+ + 2e- → H2↑
Metālu, kas šķīst (korodē), sauc par anodu, bet metālu uz kura virsmas notiek depolarizācija
(tiek saistīti anoda atbrīvotie elektroni) - par katodu.
Dažreiz korozija norisinās ar jauktu depolarizāciju, t.i., vienlaicīgi saistot skābekli un
izdaloties ūdeņradim.
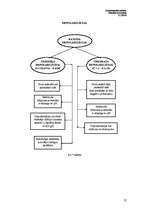
Anod- un katodiecirkņi tāpat var izveidoties uz viena metāla virsmas, piemēram,
dzelzs, kur oksīdu slānītis ir katods, bet tīrs metāls - anods.
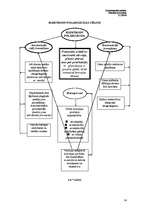
Elektroķīmiskās korozijas (EĶK) teorijas pamatā ir uzskats, ka metāla virsma ir
diferencēta katod- un anodiecirkņos un veido mikrogalvanisko elementu sistēmu.
…