-
Alumīnijs
Novērtēts!
Alumīnija iegūšanas vēsture
Pirmie šo metālu ieguva dāņu fiziķis H.Erstreds 1825.gadā un vācu ķīmiķis F.Vēlers 1827 gadā:
AlCl3+3K →3KCl+Al
Pirmo rūpniecisko alumīnija iegūšanas metodi izstrādāja franču zinātnieks A.Senklērs-Devils 1854. gadā:
Na3[AlCl6]+3Na →6NaCl+Al
Al izplatība dabā un šī metāla lielā dārdzība 19.gs. vidū bija paradokss, ko radīja grūtības Al iegūšanā. 1kg Al bija dārgāks nekā zelts. Tādējādi Al kļuva par dārgmetālu, un to sāka izmantot juvelierizstrādājumu izgatavošanā.
Alumīnija iegūšanas shēma
Alumīnija atoma uzbūve
IIIA grupas elementiem stabilākā oksidēšanās pakāpe ir +3. izņēmums ir tallijs – šī elementa stabilākā oksidēšanās pakāpe ir +1.
Al atoms satur 13p+,13e-,14n0
Alumīnija atomā elektroni ir izvietoti 3 enerģijas līmeņos: 1s22s22p63s23p1.
Īsumā par alumīniju
Alumīnijs (Al)-periodiskās sistēmas III. A grupas p elements. Atomnumurs ir 13, atommasa ir 26,98 un elektronegativitāte 1,5.
Alumīnijs savas ķīmiskās aktivitātes dēļ dabā brīvā veidā nav sastopams, bet tas ietilpst aptuveni 250 minerālos.
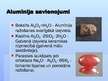
Alumīnija savienojumi
Boksīts Al2O3·nH2O - Alumīnija ražošanas svarīgākā izejviela.
Kaolīns Al2O3 · 2SiO2 · 2H2O - Galvenā izejviela keramikas rūpniecībā (galvenā mālu sastāvdaļa).
Parastais laukšpats jeb ortoklazs Na2O · Al2O3 · 6Si02 - Izmanto fajansa un porcelāna ražošanai.
Alumīnija savienojumi
Nefelīns Na2O · Al2O3 · 2SiO2 - Svarīga izejviela alumīnija iegūšanai.
Korunds Al2O3 - Slīpripu un galodu izgatavošanai.
Alumīnija savienojumi
Sarkanie paveidi-rubīni Al2O3 (kristālrežģos ir arī Cr atomi) - Pulksteņu un citu precīzu mehānismu izgatavošanai. Arī rotaslietām.
Zilie paveidi-safīri Al2O3 (kristālrežģos ir Co un Ti atomi) - Izmanto tā pat kā rubīnus.
Fizikālās īpašības
Alumīnijs ir viegls, sudrabbalts metāls, kam piemīt laba elektrovadītspēja un siltumvadītspēja. Tas ir ļoti plastisks, ar mazu cietību un mehānisko izturību. Alumīnijs ir viegli stiepjams un velvējams. No tā var izgatavot 5μm plānas loksnes (folija).
Al - kušanas temperatūra 660 grādi pēc Celsija. Viršanas temp. 2327 C. Blīvums 2698 kg/kubikmetru(20 grādos pēc celsija).
…
Tajā ir viss par alumīniju, sākot ar ieguvi un beidzot pat ar ķimiskajām reakcijām un uzdevumiem. Sīkāk-iegūšana, izamntošana, ķīmiskās, fizikālās īpašības u.c.
25 slaidi